吞噬细胞NADPH氧化酶是一种蛋白质复合物,其核心由NOX2和p22亚基组成,负责将电子从细胞内NADPH转移到细胞外氧。这个过程会产生对杀死病原体至关重要的超氧阴离子。吞噬细胞NADPH氧化酶的激活需要膜易位和几种细胞质因子的结合。然而,胞质因子结合并激活NOX2的确切机制尚不清楚。
2024年2月14日,北京大学陈雷团队在Nature 在线发表题为“Structure of human phagocyte NADPH oxidase in the activated state”的研究论文,该研究展示了人类NOX2-p22复合体的结构,该复合体由三个细胞质因子:p47、p67和Rac1的片段激活。
结构表明,p67-Rac1复合物夹住NOX2的脱氢酶结构域并诱导其收缩,从而稳定NADPH的结合,并导致NADPH结合域与黄素腺嘌呤二核苷酸(FAD)结合域之间的距离减小。此外,脱氢酶结构域停靠在NOX2跨膜结构域的底部,这减少了FAD与内层血红素之间的距离。这些结构重排可能促进了NOX2中氧化还原中心之间电子的有效转移,并导致吞噬细胞NADPH氧化酶的激活。

吞噬细胞,如中性粒细胞和巨噬细胞是专门的细胞,它们构成了抵御病原体的第一道防线。在逃避病原体的吞噬过程中,这些细胞经历了一个被称为呼吸爆发的过程,消耗氧气并产生超氧阴离子,而超氧阴离子反过来又转化为其他杀菌活性氧,如过氧化氢。这些活性氧在杀死被吞噬的病原体方面起着至关重要的作用。呼吸爆发是由吞噬细胞NADPH氧化酶介导的,它将电子从细胞内的NADPH转移到细胞外的氧气中进行还原。这种氧化酶活性的缺乏可导致慢性肉芽肿病(CGD),其特征是人类反复发生细菌感染和免疫缺陷。靶向吞噬细胞NADPH氧化酶可能为各种疾病的药物开发带来希望,如肺部炎症性疾病、中风、创伤性脑损伤和神经退行性疾病。
吞噬细胞NADPH氧化酶的膜组分是由p22和NOX2亚基组成的异二聚体复合物。NOX2是催化亚基,属于NADPH氧化酶家族。NADPH氧化酶的跨膜结构域(TMD)包含两个血红素,即内血红素和外血红素,它们之间通常有芳香残基,它们都是通过脂质双分子层的电子传递途径。电子可能通过跳跃或隧穿机制在NADPH氧化酶内部转移。这些氧化还原中心的空间排列和它们之间的距离决定了电子转移的速率,并最终影响NADPH氧化酶的整体活性。p22是NOX2的重要辅助亚基,与NOX2的TMD相互作用。p22在其胞内C端有一个富含脯氨酸的区域(PRR),该区域在NOX2激活过程中募集细胞质因子。吞噬细胞NADPH氧化酶的胞质因子包括p47、p67、p40和小的gtpase Rac1或Rac2。
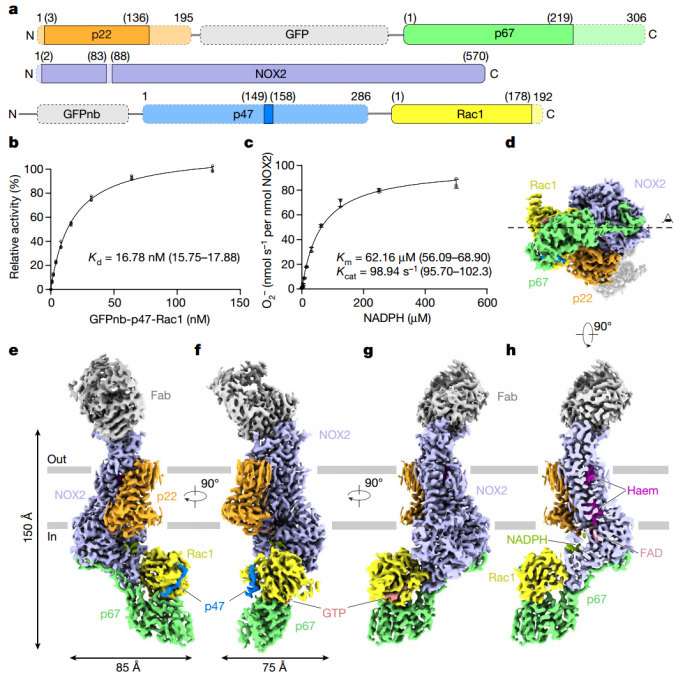
活化状态下NOX2-p22复合物的整体结构(Credit: Nature)
冷冻电镜研究揭示了NOX2和p22如何组装成异二聚体膜络合物。纳米盘中人类NOX2-p22复合物的结构进一步揭示了功能性吞噬细胞NADPH氧化酶在静息状态下的构象。此外,p67-Rac1复合物和胞质因子片段之间的其他复合物的结构为胞质因子如何相互作用提供了有价值的信息。尽管取得了这些进展,但胞质因子通过组装激活膜上NOX2-p22复合物的机制仍不清楚。
该研究揭示了由p47, p67和Rac1的基本片段激活的人类NOX2-p22复合物的冷冻电镜结构,分辨率为2.79 Å。该结构显示了p47, p67和Rac1如何组装到NOX2-p22复合体上进行激活。该研究对激活状态下人类NOX2复合体的结构阐明为进一步研究NOX2以及NADPH氧化酶其他成员的激活机制提供了框架。这种结构信息对于理解CGD等疾病的潜在致病机制至关重要。它还为针对NOX2相关疾病的基于结构的药物发现方法的发展铺平了道路。
原文链接https://www.nature.com/articles/s41586-024-07056-1













